设NA为阿伏加德罗常数的值。下列叙述正确的是()。
第1题:
设NA为阿伏伽德罗常数,下列叙述正确的是
A. 24g镁的原子量最外层电子数为NA B. 1L0.1mol·L-1乙酸溶液中H+数为0.1NA
C. 1mol甲烷分子所含质子数为10NA D. 标准状况下,22.4L乙醇的分子数为NA
【解析】A项,镁的最外层电子数为2,故错;B项,乙酸为弱电解质,部分电离,故H+小于0.1NA,错;C项,CH4的质子数为10,正确;D项,乙醇标状下不是气体,错。
第2题:
第3题:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA
B.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA
C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA
D.标准状况下,22.4 L甲醇中含有的氧原子数为1.0 NA
第4题:
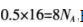 B项正确:C项.在苯中不存在C—C单键,C项错误;D项,碳酸根离子会发生水解,故碳酸钠溶液中含有的碳酸根的数目小于NA,D项错误。
B项正确:C项.在苯中不存在C—C单键,C项错误;D项,碳酸根离子会发生水解,故碳酸钠溶液中含有的碳酸根的数目小于NA,D项错误。第5题:
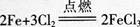 铁从0价变为+3价,l mol铁失去3 mol电子,转移电子数为N=n×NA=3XNA=3NA,但需1.5 m01氯气,所以1mol Cl2与足量的铁反应,电子转移依据氯气计算,转移电子数为2 mol,电子数为N=n×M=2×NA=2NA,D项错误。
铁从0价变为+3价,l mol铁失去3 mol电子,转移电子数为N=n×NA=3XNA=3NA,但需1.5 m01氯气,所以1mol Cl2与足量的铁反应,电子转移依据氯气计算,转移电子数为2 mol,电子数为N=n×M=2×NA=2NA,D项错误。第6题:
第7题:
第8题:
NA代表阿伏加德罗常数。下列有关叙述正确的是
A.标准状况下,2.24LH2O含有的分子数等于0.1NA
B.常温下, 溶液中阴离子总数大于0.1NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.3.4 中含N—H键数目为
第9题:
第10题:
设NA为阿伏加德罗常数,下列说法正确的是()。