298K时,下列两电极反应的标准电极电势为: Fe3++3e-→Fe;φθ(Fe3+|Fe)=-0.036V Fe2++2e-→Fe;φθ(Fe2+|Fe)=-0.439V 则反应Fe3++e-→Fe2+的φθ(Pt|Fe3+,Fe2+)等于:()。
第1题:
A、0.5007V
B、0.4315V
C、0.3407V
D、0.8407V
第2题:
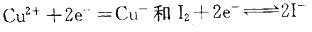 ,离子浓度升髙,它们的电极电势增加
,离子浓度升髙,它们的电极电势增加
 ,所以氧化性的强弱为MnO4- >Cr2O72-
,所以氧化性的强弱为MnO4- >Cr2O72-
 能自发进行,组成原电池时正极为Fe3+ (C1)、Fe2+ (C2) Pt,负极为 Cu Cu2+ (C3)
能自发进行,组成原电池时正极为Fe3+ (C1)、Fe2+ (C2) Pt,负极为 Cu Cu2+ (C3)
 B正确。利用电极电势的大小,可以判断电对中氧化态物质的氧化性强弱和还原态物质的还原性强弱。电极电势越高的电对中,氧化态物质的氧化性越强。所以氧化性:MnO4- >Cr2O72-
B正确。利用电极电势的大小,可以判断电对中氧化态物质的氧化性强弱和还原态物质的还原性强弱。电极电势越高的电对中,氧化态物质的氧化性越强。所以氧化性:MnO4- >Cr2O72-
第3题:
此题为判断题(对,错)。
第4题:
在下列金属电对中,标准电极电势值最小的是()
第5题:
下列电对中,若改变电极反应的pH值,则电对电极电势不变的是()
第6题:
在Fe3++e→Fe2+电极反应中,加入Fe3+的配位剂F-,则电极电势的数值升高。()
第7题:

第8题:
A.+
B.×
C.(2+)/3
D.(+)/3
第9题:
下列电极反应,其它条件不变时,将有关离子浓度减半,电极电势增大的是()
第10题:
比较题:已知反应Cu+2FeCl3=2FeCl2+CuCl2和反应CuCl2+Fe=FeCl2+Cu均向正向进行,请比较下述各氧化还原电对电极电势E的大小。(a)Cu2+/Cu(b)Fe2+/Fe(c)Fe3+/Fe