电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为________________;阴极上观察到的实验现象是___________________。
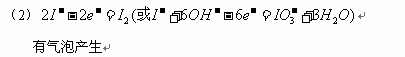
A、电子
B、离子
C、原子
D、分子
电解时,阴离子在阳极上( )电子,发生氧化反应
电解质在电解过程中,电解质的( )迁向阳极,并在阳极失去电子而被氧化。
A.阴离子
B.阳离子
1、溶解性规律——见溶解性表;2、常用酸、碱指示剂的变色范围指示剂 PH的变色范围:甲基橙 3.1红色 3.1——4.4橙色 4.4黄色酚酞 8.0无色 8.0——10.0浅红色 10.0红色石蕊 5.1红色 5.1——8.0紫色 8.0蓝色3、在惰性电极上,各种离子的放电顺序阴极(夺电子的能力):Au3+ Ag+Hg2+ Cu2+ Pb2+ Fa2+ Zn2+ H+ Al3+Mg2+ Na+ Ca2+ K+阳极(失电子的能力):S2- I- Br– Cl- OH- 含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、双水解离子方程式的书写(1)左边写出水解的离子,右边写出水解产物;(2)配平:在左边先配平电荷,再在右边配平其它原子;(3)H、O不平则在那边加水。例:当Na2CO3与AlCl3溶液混和时:3 CO32- + 2Al3+ + 3H2O = 2Al(OH)3↓ + 3CO2↑5、写电解总反应方程式的方法(1)分析:反应物、生成物是什么;(2)配平。例:电解KCl溶液: 2KCl + 2H2O == H2↑ + Cl2↑ + 2KOH配平: 2KCl + 2H2O == H2↑ + Cl2↑ + 2KOH6、将一个化学反应方程式分写成二个电极反应的方法(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。例:蓄电池内的反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O ,试写出作为原电池(放电)时的电极反应。写出二个半反应: Pb –2e- → PbSO4 PbO2 +2e- → PbSO4分析:在酸性环境中,补满其它原子,应为:负极:Pb + SO42- -2e- = PbSO4正极:PbO2 + 4H+ + SO42- +2e- = PbSO4 + 2H2O注意:当是充电时则是电解,电极反应则为以上电极反应的倒转,应为:阴极:PbSO4 +2e- = Pb + SO42-阳极:PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-7、在解计算题中常用到的恒等原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法 和估算法。(非氧化还原反应:原子守恒、电荷平衡、物料平衡用得多,氧化还原反应:电子守恒用得多)8、电子电子层结构相同的离子,核电荷数越多,离子半径越小;9、晶体的熔点原子晶体 离子晶体 分子晶体中学学到的原子晶体有: Si、SiC 、SiO2=和金刚石。原子晶体的熔点的比较是以原子半径为依据的:金刚石 SiC Si (因为原子半径:Si C O)。10、分子晶体的熔、沸点组成和结构相似的物质,分子量越大熔、沸点越高。11、胶体的带电一般说来,金属氢氧化物、金属氧化物的胶体粒子带正电,非金属氧化物、金属硫化物的胶体粒子带负电。12、氧化性MnO4- Cl2 Br2 Fe3+ I2 S=4(+4价的S)例: I2 +SO2 + H2O = H2SO4 + 2HI13、含有Fe3+的溶液一般呈酸性。14、能形成氢键的物质H2O 、NH3 、HF、CH3CH2OH 。15、氨水氨水(乙醇溶液一样)的密度小于1,浓度越大,密度越小,硫酸的密度大于1,浓度越大,密度越大,98%的浓硫酸的密度为:1.84g/cm3。16、离子是否共存(1)是否有沉淀生成、气体放出;(2)是否有弱电解质生成;(3)是否发生氧化还原反应;(4)是否生成络离子[Fe(SCN)2、Fe(SCN)3、Ag(NH3)+、[Cu(NH3)4]2+ 等];(5)是否发生双水解。

下列叙述中不正确的是()。
完成并配平反应方程式:3MnO42-+H+→3MnO4-+MnO2+H2O
完成并配平反应方程式:Cr2O72–+Fe2++H+ →Cr3++Fe3++H2O
写出下列各题的生成物并配平。 (1)Na2O2与过量冷水反应; (2)在Na2O2固体上滴加几滴热水; (3)在Na2CO3溶解中通入SO2至溶液的PH=5左右; (4)H2S通入FeCl3溶液中; (5)Cr2S3加水; (6)用盐酸酸化多硫化铵溶液; (7)Se和HNO3反应。