0.1000mol/L氢氧化钠的配制与标定步骤是什么?数据应如何处理方可符合要求?
第1题:
用氢氧化钠滴定液(0.1000mol/L)滴定20.00rnl盐酸溶液(0.1000mol/L),滴定突跃范围的pH值是
A.1.00~3.00
B.3.00~4.30
C.4.30~9.70
D.8.00~9.70
E.9.70~10.00
第2题:
A、1.00
B、3.3
C、8.0
D、9.7
第3题:
A、0.095和0.1052均应舍弃
B、0.1052应舍弃
C、0.10090应保留,0.095应舍弃
D、0.1020应保留,0.095应舍弃
第4题:
第5题:
关于氢氧化钠滴定液(0.1mol/L)的配制与标定,不正确的是
A、应用减重法精密称取在105~110℃干燥至恒重的基准物邻苯二甲酸氢钾进行标定
B、应将NaOH先配制成饱和溶液,静置数日,取上清液配制
C、冷后贮于磨口棕色试剂瓶
D、标定时用酚酞作指示剂
E、应平行测定三次,根据消耗NaOH溶液的体积,计算NaOH标准溶液的浓度和平均浓度
第6题:
用氢氧化钠滴定液(0.1000mol/L)滴定20ml醋酸溶液(0.1000mol/L),化学计量点的pH为
A.8.72
B.7.00
C.5.27
D.4.3
E.3.5
第7题:
用氢氧化钠滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L),滴定突跃范围的pH是( )
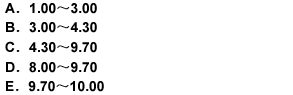
第8题:
用氢氧化钠滴定液(0.1000mol/L)滴定20ml醋酸溶液(0.1000mol/L),化学计量点的pH值为
A.8.72
B.7.O0
C.5.27
D.4.30
E.3.50
第9题:
第10题: