X(电子层结构2,8,8)
Y-(电子层结构2,8)
Z+(电子层结构2,8)
R+(电子层结构2,8,8)
第1题:
对任何一个化学平衡体系,采取以下措施一定会使平衡发生移动的是()。
A.加入一种反应物
B.升高温度
C.增大平衡体系的压强
D.使用催化剂
第2题:
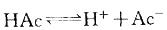 平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关:
平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关: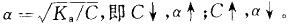 。
。第3题:
25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
C【解析】相同浓度时,Na2CO3的碱性强于NaHCO3,C项错。
第4题:
对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是()
第5题:
第6题:
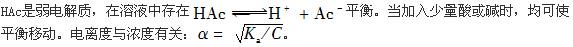
第7题:
第8题:
纯水中加入NaCl后,会使水的沸点降低、凝固点升高 ( )
第9题:
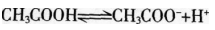 ,对该平衡下列叙述中,正确的是( )。
,对该平衡下列叙述中,正确的是( )。
第10题:
在纯水中加入强酸时,水的电离平衡移动方向为()。