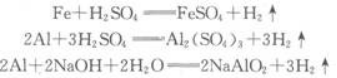第1题:
A28
B56
C112
D224
第2题:
将铁片放入下列溶液中,充分反应后溶液质量减小的是( )
A.三氯化铁
B.稀硫酸
C.硫酸铜
D.浓盐酸
第3题:
下列各组物质充分反应后,溶液质量比反应前的溶液质量减小的是【】
A.铁片浸入稀硫酸中
B.铁片浸入硫酸铜溶液中
C.氧化铁粉末加入稀盐酸中
D.碳酸氢钠粉末加入稀盐酸中
第4题:

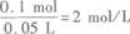

第5题:
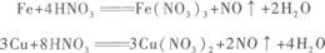
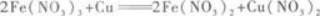
第6题:
A.氢气能在氯气中燃烧
B.氢气与氧气混合即发生爆炸
C.用氢气冶炼金属时,氢气是还原剂
D.不能用铜和稀硫酸反应直接制取氢气
第7题:
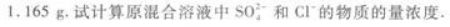


第8题:
铁盐检查时,需加入过硫酸铵固体适量的目的在于( )。
A.消除干扰
B.加速Fe3+和SCN-反应速度
C.增加颜色深度
D.将低价态铁离子Fe2+氧化为高价态铁离子(Fe3+),同时防止硫氰酸铁在光线作用下,发生还原或分解反应而褪色
E.将高价态铁离子(Fe3+)还原为低价态铁离子(Fe2+)
第9题:
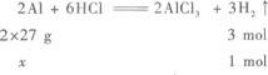

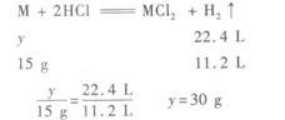
第10题: