常温下pH值均为3的醋酸溶液与盐酸溶液,以下说法错误的是()。
第1题:


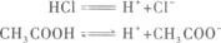
第2题:
第3题:
调节盐酸普鲁卡因溶液pH宜用
A、盐酸
B、硫酸
C、醋酸
D、枸橼酸
E、缓冲溶液
第4题:
甲、乙、丙3支试管,分别注入同体积的0.1mol/L的盐酸、硫酸和醋酸,再各加入同浓度等体积的碳酸钠溶液,现测得甲试管中溶液的pH为7,则()
第5题:
取pH均为2盐酸和醋酸各100毫升,分别加水稀释两倍后,再分别加入6.5克锌粉,相同条件下充分反应,下列说法错误的是()。
第6题:
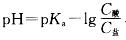 ,溶液稀释pH不变。
,溶液稀释pH不变。第7题:
pH=3的盐酸溶液与等体积pH=5的盐酸溶液混合后,pH值等于()
第8题:
下面的说法( )是错误的。
A.PH值越小,溶液的酸性越强
B.PH值越大,溶液的碱性越强
C.PH值不能大于14
D.P溶液中,P氢离子POH=14
第9题:
关于盐酸与醋酸两种稀溶液的说法错误的是()。
第10题:
在醋酸溶液中加入盐酸,溶液的PH值()。